Сердечная недостаточность у собак и кошек
Заболевания сердца неизбежно прогрессируют, но не всегда приводят к развитию сердечной недостаточности. Прогноз дальнейшего течения болезни зависит от общего состояния здоровья животного, типа заболевания сердца и скорости его прогрессирования.1
Понятие «сердечная недостаточность» используют по отношению к таким клиническим проявлениям, как накопление жидкости в легких или брюшной полости, которые возникают из-за неспособности сердца надлежащим образом компенсировать изменения, вызванные заболеванием.
Сегодня в случае развития сердечной недостаточности предоставляются рекомендации по питанию, направленные на восполнение дефицита питательных веществ, контроль клинических проявлений, поддержание достаточного потребления калорий и белков для сохранения мышечной массы тела и предотвращения кахексии.
На клеточном уровне сердечная недостаточность проявляется в качестве дефицита энергии. Происходит нарушение функции митохондрий, энергетический метаболизм становится неэффективным, и снижается сократимость сердца.2
Узнайте больше о биоэнергетических изменениях при сердечной недостаточности, которые послужили поводом для применения инновационных методов питания для поддержания здоровья сердца.
Рентгенограмма грудной клетки в правой боковой проекции небольшой собаки, стадия C по классификации ACVIM, сердечная недостаточность

Изображение предоставлено Ребеккой Л. Степин (Rebecca L. Stepien), ветеринарный врач, магистр наук, дипломированный специалист ACVIM (кардиология), Висконсинский университет, США
Клинические признаки сердечной недостаточности сложно не заметить: вялость, учащенное дыхание, кашель и асцит. В случае поздней стадии заболевания сердца Американский колледж ветеринарной внутренней медицины (ACVIM) дает несколько рекомендаций по питанию.1

Однако изменения на клеточном уровне не так легко распознать.

Нарушение энергетического метаболизма в сердце является главной особенностью сердечной недостаточности.2-5
Энергетический метаболизм в митохондриях сердца состоит из трех этапов:2-5
- Использование источников энергии (жирных кислот, глюкозы и других питательных веществ)
- Выработка энергии (АТФ)
- Перенос АТФ в миофибриллы (волокно сердечной мышцы) и его использование
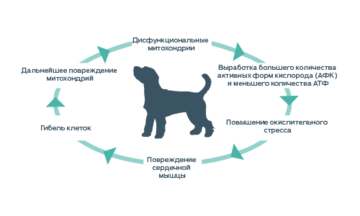
Результаты исследований сердечной недостаточности показали, что изменения могут происходить на любом одном или на всех трех этапах энергетического метаболизма.2
При снижении сердечной функции изменение любого этапа энергетического метаболизма негативно влияет на остальные аспекты синтеза АТФ.
В конечном счете, сердечная недостаточность приводит к дефициту энергии.2, 6, 7
Исследования указывают на то, что в условиях сердечной недостаточности митохондрии начинают использовать другие субстраты для выработки энергии. Процесс выработки энергии митохондриями в целом становится менее эффективным.


Научные сотрудники компании Purina применили прогрессивные методы метаболомики и транскриптомики для исследования митрального клапана и миокардиальной ткани, чтобы лучше понять основные изменения, происходящие в организме собак с миксоматозной дегенерацией митрального клапана (МДМК) на ранней стадии.8
Исследования в рамках наук-«омик», проведенные как с участием людей, так и животных, показали, что экспрессия генов и профили метаболитов, связанных с энергетическим метаболизмом, значительно отличаются у субъектов со здоровым сердцем и с сердечной недостаточностью.8–10
Научные сотрудники компании Purina обнаружили, что у здоровых собак и собак с МДМК были дифференциально экспрессированы более 1000 транскриптов.
Гены, экспрессируемые в клетках собак с МДМК, были связаны с измененным каскадом реакций в следующем:
- Энергетический метаболизм
- Окислительный стресс
- Медиаторы воспаления
- Гомеостаз внеклеточного матрикса митрального клапана
Как и в случае с результатами исследований сердечной недостаточности у человека, эти изменения свидетельствуют о том, что у собак с МДМК также наблюдается переход от использования митохондриями длинноцепочечных жирных кислот в качестве основного источника энергии на другие субстраты и в целом менее эффективное использование источников энергии.
Данные этих исследований в рамках наук-«омик» и результаты новых исследований лечебного питания12 позволяют предположить, что наличие доступных альтернативных источников для энергетического метаболизма способно улучшить контроль над течением заболевания, результативность лечения или даже предотвратить развитие заболеваний сердца.
- Заболевания сердца не всегда приводят к развитию сердечной недостаточности. Прогнозы зависят от заболевания, скорости его прогрессирования и общего состояния здоровья животного.
- Понятие «сердечная недостаточность» используют по отношению к клиническим проявлениям, которые возникают из-за неспособности сердца компенсировать изменения, вызванные заболеванием.
- Результаты исследований показывают, что энергетический метаболизм в сердце значительно отличается у пациентов со здоровым сердцем и с сердечной недостаточностью.
- Исследования указывают на то, что питательные вещества, обеспечивающие альтернативные источники энергии для митохондрий сердца, способны помочь в поддержании здоровья сердца.
1. Keene, B. W., Atkins, C. E., Bonagura, J. D., Fox, P. R., Häggström, J., Fuentes, V. L., Oyama, M. A., Rush, J. E., Stepien, R., & Uechi, M. (2019). ACVIM consensus guidelines for the diagnosis and treatment of myxomatous mitral valve disease in dogs. Journal of Veterinary Internal Medicine, 33(3), 1127–1140.
2. Neubauer, S. (2007). The failing heart – an engine out of fuel. The New England Journal of Medicine, 356(11), 1140–1151.
3. Lopaschuk, G. (2017). Metabolic Modulators in Heart Disease: Past, Present, and Future. Canadian Journal of Cardiology, 33, 838–849.
4. Sabbah, H. N. (2020). Targeting the Mitochondria in Heart Failure: A Translational Perspective. JACC. Basic to Translational Science, 5(1), 88–106.
5. Taegtmeyer, H. (2004). Cardiac metabolism as a target for the treatment of heart failure. Circulation,110(8), 894–896.
6. Doenst, T., Nguyen, T. D., & Abel, E. D. (2013). Cardiac metabolism in heart failure: implications beyond ATP production. Circulation Research, 113(6), 709–724.
7. Karwi, Q. G., Uddin, G. M., Ho, K. L., & Lopaschuk, G. D. (2018). Loss of Metabolic Flexibility in the Failing Heart. Frontiers in Cardiovascular Medicine, 5, 68.
8. Li, Q., Freeman, L. M., Rush, J. E., Huggins, G. S., Kennedy, A.D., Labuda, J.A., Laflamme, D.P., & Hannah, S.S. (2015). Veterinary Medicine and Multi-Omics Research for Future Nutrition Targets: Metabolomics and Transcriptomics of the Common Degenerative Mitral Valve Disease in Dogs. OMICS, 19(8), 461–470.
9. Jiang, L., Wang, J., Li, R., Fang, Z.M., Zhu, X.H., Yi, X., ... Jiang, D.S. (2019). Disturbed energy and amino acid metabolism with their diagnostic potential in mitral valve disease revealed by untargeted plasma metabolic profiling. Metabolomics, 15(4), 57.
10. Lanfear, D. E., Gibbs, J. J., Li, J., She, R., Petucci, C., Culver, J. A., … Gardell, S. J. (2017). Targeted Metabolomic Profiling of Plasma and Survival in Heart Failure Patients. Journal of the American College of Cardiology,Heart failure, 5(11), 823–832.
11. Oyama, M. A., & Chittur, S. V. (2006). Genomic expression patterns of mitral valve tissues from dogs with degenerative mitral valve disease. American Journal of Veterinary Research, 67(8), 1307–1318.
12. Brown, D. A., Perry, J. B., Allen, M. E., Sabbah, H. N., Stauffer, B. L., Shaikh, S. R., … Gheorghiade, M. (2017). Expert consensus document: Mitochondrial function as a therapeutic target in heart failure. Nature reviews. Cardiology, 14(4), 238–250.


